Bienvenue chez Justin Stindt Consultants, votre agence de confiance spécialisée dans l’évaluation clinique conjointe (Joint Clinical Assessment, JCA) dans l’Union européenne (UE). Alors que la Communauté européenne s’engage dans un nouveau processus paneuropéen d’HTA, la JCA vise à harmoniser l’évaluation des thérapies innovantes dans les États membres de la Communauté économique européenne. Notre équipe mondiale d’experts et de consultants maîtrise parfaitement ce paysage transformateur, garantissant que vos applications répondent aux normes rigoureuses établies par le Health Technology Assessment Coordination Group (HTACG). En tant qu’agence de conseil internationale avec une expérience réussie dans les dossiers nationaux P&R et les projets paneuropéens, nous soulignons l’importance d’articuler les avantages supplémentaires de votre produit pour une entrée réussie sur le marché de l’UE. Faites confiance à Justin Stindt Consultants comme partenaire pour libérer le potentiel de vos solutions médicales innovantes dans le cadre d’accès au marché en évolution de l’Union européenne.
Évaluation clinique conjointe (JCA) dans l'UE : défis et opportunités pour les sociétés pharmaceutiques dans le nouveau processus paneuropéen d'HTA
Le processus d’évaluation clinique conjointe (JCA) dans l’Union européenne représente un nouveau processus paneuropéen d’HTA progressivement mis en œuvre à partir de 2025. Même si beaucoup espèrent que cela signifiera une étape significative vers l’amélioration de l’évaluation collaborative des thérapies innovantes dans les États membres, des inquiétudes subsistent au sein de l’industrie quant au risque que cela conduise à une duplication des efforts aux niveaux européen et national. JCA cherche à rationaliser et à harmoniser l’évaluation des nouveaux traitements, dans le but d’optimiser l’accès des patients aux médicaments et dispositifs médicaux de pointe tout en garantissant la rentabilité et la sécurité des patients. Justin Stindt Consultants est une agence spécialisée dans les dossiers d’HTA européens (JCA) et nationaux. Notre équipe expérimentée de consultants et d’experts vous aidera à articuler les avantages supplémentaires de votre produit dans le dossier JCA.
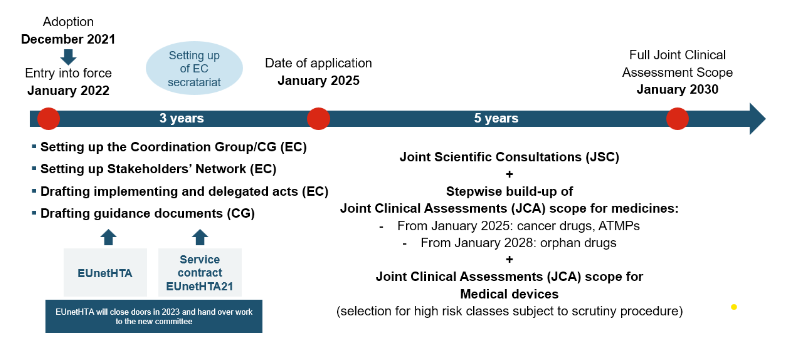
Règlement HTA – Calendrier de mise en œuvre et accès au marché
La promesse de l’évaluation clinique conjointe (JCA) dans l’UE : un processus plus rapide et plus efficace
La JCA sera menée par le Groupe de coordination de l’évaluation des technologies de la santé (HTACG), créé par le règlement sur l’évaluation des technologies de la santé (HTAR). Le sous-groupe pour les évaluations cliniques conjointes assistera le HTACG. Le groupe de coordination rassemble divers organismes nationaux d’évaluation des technologies de la santé (HTA) et des experts de différents pays de l’UE pour évaluer conjointement les données cliniques et les preuves soutenant une thérapie particulière. En mutualisant les ressources et l’expertise, JCA vise à offrir une approche efficace pour évaluer la valeur clinique et économique des traitements innovants, en réduisant les évaluations redondantes et en accélérant les processus de prise de décision.
Les défis de l’évaluation clinique conjointe (JCA) dans l’UE : répondre aux besoins de systèmes de santé très différents
 Les défis du processus JCA proviennent de la diversité des systèmes de santé européens, des priorités de traitement et des populations de patients parmi les États membres de l’UE. L’harmonisation des critères et l’alignement des méthodes d’évaluation peuvent être complexes, nécessitant une communication et une coopération solides entre les pays participants. De plus, des interprétations différentes des données et des preuves cliniques peuvent émerger, nécessitant un dialogue ouvert et la recherche d’un consensus au cours de l’évaluation. Un défi majeur est l’alignement sur les PICO [PICO = Population, Intervention, Comparator(s), Outcomes(s)], où les États membres peuvent avoir des attentes très différentes en fonction de leur système de santé et de l’ensemble des comparateurs disponibles.
Les défis du processus JCA proviennent de la diversité des systèmes de santé européens, des priorités de traitement et des populations de patients parmi les États membres de l’UE. L’harmonisation des critères et l’alignement des méthodes d’évaluation peuvent être complexes, nécessitant une communication et une coopération solides entre les pays participants. De plus, des interprétations différentes des données et des preuves cliniques peuvent émerger, nécessitant un dialogue ouvert et la recherche d’un consensus au cours de l’évaluation. Un défi majeur est l’alignement sur les PICO [PICO = Population, Intervention, Comparator(s), Outcomes(s)], où les États membres peuvent avoir des attentes très différentes en fonction de leur système de santé et de l’ensemble des comparateurs disponibles.
Pour les entreprises pharmaceutiques et biotechnologiques, peu importe leur taille, le processus d’évaluation clinique conjointe (JCA) dans l’Union européenne peut être à la fois un défi et un tournant.
Le processus JCA dans l’Union européenne marque une avancée significative vers l’évaluation collaborative des thérapies innovantes, visant à rationaliser les évaluations dans les États membres. Cette initiative offre des avantages potentiels en termes d’accès pour les patients, de rentabilité et d’efficacité décisionnelle. Cependant, des défis découlent de la diversité des systèmes de santé et des différentes interprétations des données.
Pour les sociétés pharmaceutiques souhaitant entrer sur le marché, s’adapter à cette approche est crucial ; les petites entreprises doivent s’engager activement avec les organismes locaux d’HTA et affiner les méthodologies pour les produits avancés, tandis que les grandes entreprises doivent aligner les stratégies régionales et locales pour garantir la mise en œuvre et l’adoption efficaces des rapports JCA. En résumé, la JCA est prometteuse pour améliorer les processus d’évaluation tout en exigeant l’adaptabilité et la coopération de la part de l’industrie et des organismes de réglementation. Les entreprises à la recherche d’un fournisseur à soutenir dans le cadre des JCA peuvent trouver en Justin Stindt Consultants un prestataire de services de confiance, tirant parti de l’expertise de notre réseau d’experts et de nos antécédents réussis en matière de dossiers P&R nationaux et de projets paneuropéens.
Calendrier et modalités de soumission de l’évaluation clinique conjointe
Le JCA sera publié au plus tard 30 jours après la publication de l’EPAR. Le rapport de la JCA devant être publié 30 jours seulement après la décision du CHMP, les procédures nationales pourraient démarrer très rapidement.
Les entreprises devront soumettre un dossier 45 jours avant l’avis du CHMP. Les spécifications des dossiers sont déterminées dans le RÈGLEMENT (UE) 2021/2282 : Annexe I pour les médicaments et Annexe II pour les dispositifs médicaux et les dispositifs médicaux de diagnostic in vitro.
Les résultats des JCA seront publiés 30 jours après la décision du CHMP afin de pouvoir influencer les procédures nationales.
Justin Stindt Consultants : une agence de conseil expert spécialisée dans les dossiers de prix et de remboursement dans l'UE / JCA

Consultation scientifique conjointe (JSC) : avis scientifique paneuropéen
Les entreprises pharmaceutiques, biotechnologiques et médicales pourront également demander une consultation scientifique conjointe (JSC) auprès du groupe de coordination lors de la planification des études cliniques. Pour plus d’informations, visitez notre page de consultation scientifique conjointe de l’UE.
Justin Stindt Consultants est votre agence avec les bons experts pour soutenir la préparation des dossiers JCA. Nos services comprennent (sans s’y limiter) :
- Planification de projet complète avec des échéances et des étapes claires
- Revue stratégique du positionnement du médicament
- Rédaction de dossiers, en anglais et dans d’autres langues de l’UE
- Validation des dossiers auprès des Key Opinion Leaders (KOL) / Key External Experts (KEE) et des payeurs
- Conseils et assistance pour le processus de soumission
- Conseil stratégique et participation aux négociations de prix au niveau national
- Gestion de projet et communication efficaces tout au long du processus
Chez Justin Stindt Consultants, notre équipe d’experts possède une vaste expérience dans l’accompagnement sur mesure pour permettre l’accès aux patients de l’UE le plus rapidement possible à des conditions de prix et de remboursement durables.
Laissez Justin Stindt Consultants être votre agence partenaire de confiance pour débloquer des opportunités de prix et de remboursement (P&R) pour votre produit dans l’UE.
Contactez-nous dès aujourd’hui pour découvrir comment notre entreprise peut adapter nos services pour répondre à vos besoins uniques et faire de vos objectifs de prix et de remboursement une réalité.
Rencontrez l’un de nos experts UE en matière de prix et de remboursement

Contactez notre expert
Contacter notre équipe
Nos spécialistes expérimentés en accès aux marchés sont à portée de clic.
TÉMOIGNAGES CLIENTS