Willkommen bei Justin Stindt Consultants, Ihrer vertrauenswürdigen Agentur, die sich auf Joint Clinical Assessment (JCA) in der Europäischen Union (EU) spezialisiert hat. Während die Europäische Gemeinschaft einen neuen europaweiten HTA-Prozess einleitet, zielt die JCA darauf ab, die Bewertung innovativer Therapien in den Mitgliedstaaten der Europäischen Wirtschaftsgemeinschaft zu harmonisieren. Unser globales Team aus Experten und Beratern beherrscht diese transformative Landschaft kompetent und stellt sicher, dass Ihre Anwendungen den strengen Standards der Health Technology Assessment Coordination Group (HTACG) entsprechen. Als internationale Beratungsagentur mit einer erfolgreichen Erfolgsbilanz in nationalen P&R-Dossiers und pan-EU-Projekten legen wir Wert darauf, den Mehrwert Ihres Produkts für einen erfolgreichen Markteintritt in der EU zu artikulieren. Verlassen Sie sich auf Justin Stindt Consultants als Ihren Partner bei der Erschließung des Potenzials Ihrer innovativen medizinischen Lösungen im sich entwickelnden Marktzugangsrahmen der Europäischen Union.
Joint Clinical Assessment (JCA) in der EU: Herausforderungen und Chancen für Pharmaunternehmen im neuen europaweiten HTA-Prozess
Der Joint Clinical Assessment (JCA)-Prozess in der Europäischen Union stellt einen neuen europaweiten HTA-Prozess dar, der ab 2025 schrittweise umgesetzt wird. Während viele hoffen, dass dies einen bedeutenden Schritt zur Verbesserung der gemeinsamen Bewertung innovativer Therapien in den Mitgliedstaaten bedeuten wird, gibt es in der Branche immer noch Bedenken, dass dies zu einer Doppelarbeit auf EU- und nationaler Ebene führen wird. JCA ist bestrebt, die Bewertung neuer Behandlungen zu rationalisieren und zu harmonisieren, um den Patientenzugang zu modernsten Medikamenten und medizinischen Geräten zu optimieren und gleichzeitig Kosteneffizienz und Patientensicherheit zu gewährleisten. Justin Stindt Consultants ist eine auf EU- (JCA) und nationale HTA-Dossiers spezialisierte Agentur. Unser erfahrenes Team aus Beratern und Experten hilft Ihnen dabei, den Zusatznutzen Ihres Produkts im JCA-Dossier zu artikulieren.
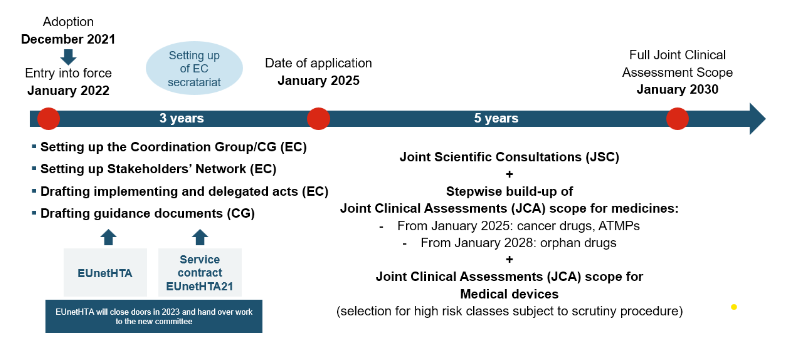
HTA-Verordnung – Zeitplan für Umsetzung und Marktzugang
Das Versprechen der Joint Clinical Assessment (JCA) in der EU: Ein schnellerer und effizienterer Prozess
Die JCA wird von der Health Technology Assessment Coordination Group (HTACG) durchgeführt, die durch die Verordnung zur Health Technology Assessment (HTAR) eingerichtet wurde. Die Untergruppe für gemeinsame klinische Bewertungen wird die HTACG unterstützen. Die Koordinierungsgruppe bringt verschiedene nationale Gremien für die Bewertung von Gesundheitstechnologien (HTA) und Experten aus verschiedenen EU-Ländern zusammen, um gemeinsam die klinischen Daten und Beweise für eine bestimmte Therapie zu bewerten. Durch die Bündelung von Ressourcen und Fachwissen möchte JCA einen effizienten Ansatz zur Bewertung des klinischen und wirtschaftlichen Werts innovativer Behandlungen bieten, redundante Bewertungen reduzieren und Entscheidungsprozesse beschleunigen.
Herausforderungen des Joint Clinical Assessment (JCA) in der EU: Berücksichtigung der Bedürfnisse sehr unterschiedlicher Gesundheitssysteme
 Herausforderungen im JCA-Prozess ergeben sich aus der Vielfalt der europäischen Gesundheitssysteme, Behandlungsprioritäten und Patientenpopulationen in den EU-Mitgliedstaaten. Die Harmonisierung von Kriterien und die Angleichung von Bewertungsmethoden können komplex sein und erfordern eine solide Kommunikation und Zusammenarbeit zwischen den teilnehmenden Ländern. Darüber hinaus kann es zu unterschiedlichen Interpretationen klinischer Daten und Beweise kommen, was einen offenen Dialog und die Konsensbildung während der Beurteilung erforderlich macht. Eine zentrale Herausforderung ist die Einigung auf die PICOs [PICO = Population, Intervention, Comparator(s), Outcomes(s)], bei denen die Mitgliedstaaten beispielsweise abhängig von ihrem Gesundheitssystem und den verfügbaren Vergleichstherapien sehr unterschiedliche Erwartungen haben können.
Herausforderungen im JCA-Prozess ergeben sich aus der Vielfalt der europäischen Gesundheitssysteme, Behandlungsprioritäten und Patientenpopulationen in den EU-Mitgliedstaaten. Die Harmonisierung von Kriterien und die Angleichung von Bewertungsmethoden können komplex sein und erfordern eine solide Kommunikation und Zusammenarbeit zwischen den teilnehmenden Ländern. Darüber hinaus kann es zu unterschiedlichen Interpretationen klinischer Daten und Beweise kommen, was einen offenen Dialog und die Konsensbildung während der Beurteilung erforderlich macht. Eine zentrale Herausforderung ist die Einigung auf die PICOs [PICO = Population, Intervention, Comparator(s), Outcomes(s)], bei denen die Mitgliedstaaten beispielsweise abhängig von ihrem Gesundheitssystem und den verfügbaren Vergleichstherapien sehr unterschiedliche Erwartungen haben können.
Für große und kleine Pharma- und Biotechunternehmen kann der Joint Clinical Assessment (JCA)-Prozess in der Europäischen Union sowohl eine Herausforderung als auch ein Wendepunkt sein.
Der JCA-Prozess in der Europäischen Union stellt einen bedeutenden Schritt in Richtung einer gemeinsamen Bewertung innovativer Therapien dar, mit dem Ziel, die Bewertungen in allen Mitgliedstaaten zu rationalisieren. Diese Initiative bietet potenzielle Vorteile im Hinblick auf Patientenzugang, Kosteneffizienz und Entscheidungseffizienz. Allerdings ergeben sich durch unterschiedliche Gesundheitssysteme und unterschiedliche Interpretationen von Daten Herausforderungen.
Für Pharmaunternehmen, die in den Markt eintreten möchten, ist die Anpassung an diesen Ansatz von entscheidender Bedeutung. Kleine Unternehmen müssen aktiv mit lokalen HTA-Gremien zusammenarbeiten und Methoden für fortschrittliche Produkte verfeinern, während größere Unternehmen regionale und lokale Strategien aufeinander abstimmen müssen, um die effektive Umsetzung und Annahme von JCA-Berichten sicherzustellen. Zusammenfassend lässt sich sagen, dass JCA eine Verbesserung der Bewertungsprozesse verspricht und gleichzeitig Anpassungsfähigkeit und Zusammenarbeit sowohl von der Industrie als auch von den Regulierungsbehörden fordert. Unternehmen, die einen Lieferanten zur Unterstützung bei JCAs suchen, finden in Justin Stindt Consultants einen vertrauenswürdigen Dienstleister, der die Expertise unseres Expertennetzwerks und die erfolgreiche Erfolgsbilanz bei nationalen P&R-Dossiers und europaweiten Projekten nutzt
Zeitpläne und Einreichungsmodalitäten für die gemeinsame klinische Bewertung (JCA).
Die JCA wird spätestens 30 Tage nach der EPAR-Veröffentlichung veröffentlicht. Da der JCA-Bericht nur 30 Tage nach der CHMP-Entscheidung veröffentlicht werden soll, könnten nationale Verfahren sehr schnell beginnen Unternehmen müssen 45 Tage vor der Stellungnahme des CHMP ein Dossier einreichen. Die Dossierspezifikationen werden in der VERORDNUNG (EU) 2021/2282 festgelegt: Anhang I für Arzneimittel und Anhang II für Medizinprodukte und In-vitro-Diagnostika.
Das Ergebnis der JCAs wird 30 Tage nach der CHMP-Entscheidung veröffentlicht, damit es Einfluss auf die nationalen Verfahren haben kann.
Justin Stindt Consultants: Eine auf EU-Preis- und Erstattungsdossiers spezialisierte Expertenberatungsagentur / JCA

Joint Scientific Consultation (JSC): Paneuropäische wissenschaftliche Beratung
Pharma-, Biotech- und Medizintechnikunternehmen können bei der Planung klinischer Studien auch eine gemeinsame wissenschaftliche Konsultation (Joint Scientific Consultation, JSC) bei der Koordinierungsgruppe beantragen. Weitere Informationen finden Sie auf unserer Seite zur gemeinsamen wissenschaftlichen Konsultation der EU.
Justin Stindt Consultants ist Ihre Agentur mit den richtigen Experten für die Unterstützung bei der Erstellung von JCA-Dossiers. Unsere Dienstleistungen umfassen (nicht beschränkt auf):
- Umfassende Projektplanung mit klaren Zeitplänen und Meilensteinen
- Strategische Überprüfung der Arzneimittelpositionierung
- Verfassen von Dossiers, sowohl auf Englisch als auch in anderen EU-Sprachen
- Dossiervalidierung mit wichtigen Meinungsführern und Kostenträgern
- Anleitung und Unterstützung beim Einreichungsprozess
- Strategische Beratung und Teilnahme an Preisverhandlungen auf nationaler Ebene
- Effektives Projektmanagement und Kommunikation während des gesamten Prozesses
Bei Justin Stindt Consultants verfügt unser Expertenteam über umfassende Erfahrung darin, unseren Kunden maßgeschneiderte Unterstützung zu bieten, um EU-Patienten so schnell wie möglich Zugang zu nachhaltigen Preis- und Erstattungsbedingungen zu ermöglichen.
Machen Sie Justin Stindt Consultants zu Ihrem vertrauenswürdigen Agenturpartner bei der Erschließung von Preis- und Erstattungsmöglichkeiten (P&R) für Ihr Produkt in der EU.
Kontaktieren Sie uns noch heute, um zu erfahren, wie unser Unternehmen unsere Dienstleistungen an Ihre individuellen Bedürfnisse anpassen und Ihre Preis- und Erstattungsziele verwirklichen kann.
Treffen Sie einen unserer EU-Experten für Preis- und Erstattungsdossiers

Nehmen Sie Kontakt mit unserem Experten auf
Kontaktieren Sie unser Team
Unsere Erfahrenen Marktzugangsspezialisten Sind Nur Einen Klick Entfernt
KUNDENBEWERTUNGEN