Benvenuto in Justin Stindt Consultants, la tua agenzia di fiducia specializzata nella valutazione clinica congiunta (JCA) nell’Unione Europea (UE). Mentre la Comunità Europea intraprende un nuovo processo paneuropeo di HTA, la JCA mira ad armonizzare la valutazione delle terapie innovative tra gli stati membri della Comunità Economica Europea. Il nostro team globale di esperti e consulenti è abile nell’affrontare questo panorama in trasformazione, garantendo che le vostre applicazioni soddisfino i rigorosi standard stabiliti dall’Health Technology Assessment Coordination Group (HTACG). In qualità di agenzia di consulenza internazionale con un track record di successo in dossier P&R nazionali e progetti pan-UE, sottolineiamo l’importanza di articolare il vantaggio aggiuntivo del vostro prodotto per un ingresso di successo sul mercato dell’UE. Affidati a Justin Stindt Consultants come partner per sbloccare il potenziale delle tue soluzioni mediche innovative nel contesto in evoluzione dell’accesso al mercato dell’Unione Europea.
Valutazione clinica congiunta (jca) nell’ue: sfide e opportunità per le aziende farmaceutiche nel nuovo processo paneuropeo di HTA
Il processo di Valutazione Clinica Congiunta (JCA) nell’Unione Europea rappresenta un nuovo processo paneuropeo di HTA in fase di implementazione progressiva dal 2025 in poi. Mentre molti sperano che ciò significhi un passo significativo verso il miglioramento della valutazione collaborativa delle terapie innovative tra gli Stati membri, ci sono ancora preoccupazioni nel settore che ciò porterà a una duplicazione degli sforzi a livello UE e nazionale. JCA mira a semplificare e armonizzare la valutazione di nuovi trattamenti, con l’obiettivo di ottimizzare l’accesso dei pazienti a farmaci e dispositivi medici all’avanguardia, garantendo al tempo stesso il rapporto costo-efficacia e la sicurezza dei pazienti. Justin Stindt Consultants è un’agenzia specializzata in dossier HTA UE (JCA) e nazionali. Il nostro team esperto di consulenti ed esperti ti aiuterà ad articolare il vantaggio aggiuntivo del tuo prodotto nel dossier JCA.
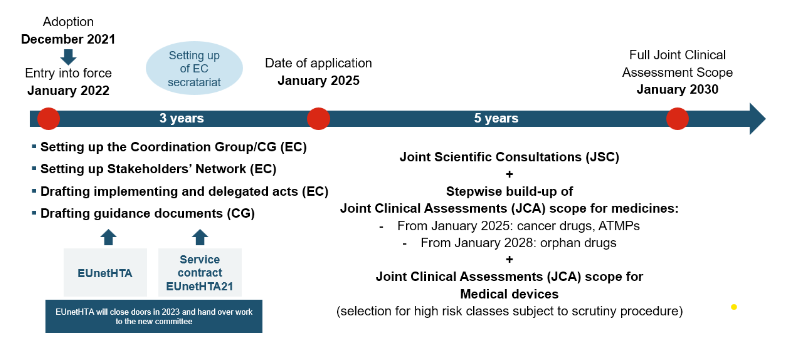
Regolamento HTA – tempi di attuazione e accesso al mercato
La promessa della valutazione clinica congiunta (JCA) nell’EU: un processo più rapido ed efficiente
La JCA sarà condotta dal gruppo di coordinamento della valutazione delle tecnologie sanitarie (HTACG), istituito dal regolamento sulla valutazione delle tecnologie sanitarie (HTAR). Il sottogruppo per le valutazioni cliniche congiunte assisterà l’HTACG. Il gruppo di coordinamento riunisce vari organismi nazionali di valutazione delle tecnologie sanitarie (HTA) ed esperti di diversi paesi dell’UE per valutare congiuntamente i dati clinici e le prove a sostegno di una particolare terapia. Mettendo in comune risorse e competenze, JCA mira a offrire un approccio efficiente per valutare il valore clinico ed economico dei trattamenti innovativi, riducendo le valutazioni ridondanti e accelerando i processi decisionali.
Le sfide della valutazione clinica congiunta (JCA) nell’EU: soddisfare le esigenze di sistemi sanitari molto diversi
 Le sfide nel processo JCA derivano dalla diversità dei sistemi sanitari europei, delle priorità terapeutiche e delle popolazioni di pazienti tra gli Stati membri dell’UE. L’armonizzazione dei criteri e l’allineamento dei metodi di valutazione possono essere complessi e richiedono una solida comunicazione e cooperazione tra i paesi partecipanti. Inoltre, possono emergere interpretazioni divergenti dei dati clinici e delle evidenze, che richiedono un dialogo aperto e la creazione di consenso durante la valutazione. Una sfida chiave è l’allineamento sui PICO [PICO = Population, Intervention, Comparator(s), Outcomes(s) – Popolazione, Intervento, Comparatori, Risultati], in cui gli Stati membri possono avere aspettative molto diverse a seconda del loro sistema sanitario e della serie di comparatori disponibili.
Le sfide nel processo JCA derivano dalla diversità dei sistemi sanitari europei, delle priorità terapeutiche e delle popolazioni di pazienti tra gli Stati membri dell’UE. L’armonizzazione dei criteri e l’allineamento dei metodi di valutazione possono essere complessi e richiedono una solida comunicazione e cooperazione tra i paesi partecipanti. Inoltre, possono emergere interpretazioni divergenti dei dati clinici e delle evidenze, che richiedono un dialogo aperto e la creazione di consenso durante la valutazione. Una sfida chiave è l’allineamento sui PICO [PICO = Population, Intervention, Comparator(s), Outcomes(s) – Popolazione, Intervento, Comparatori, Risultati], in cui gli Stati membri possono avere aspettative molto diverse a seconda del loro sistema sanitario e della serie di comparatori disponibili.
Per le aziende farmaceutiche e biotech, sia grandi che piccole, il processo di valutazione clinica congiunta (JCA) dell’Unione europea può rappresentare sia una sfida che un punto di svolta.
Il processo JCA nell’Unione Europea segna un passo significativo verso la valutazione collaborativa di terapie innovative, con l’obiettivo di semplificare le valutazioni tra gli Stati membri. Questa iniziativa offre potenziali vantaggi in termini di accesso dei pazienti, rapporto costo-efficacia ed efficienza del processo decisionale. Tuttavia, le sfide derivano dalla diversità dei sistemi sanitari e dalle diverse interpretazioni dei dati.
Per le aziende farmaceutiche che desiderano entrare nel mercato, adattarsi a questo approccio è fondamentale; le piccole imprese devono impegnarsi attivamente con gli organismi HTA locali e perfezionare le metodologie per prodotti avanzati, mentre le aziende più grandi devono allineare le strategie regionali e locali per garantire l’effettiva implementazione e adozione dei rapporti JCA. In sintesi, la JCA promette di migliorare i processi di valutazione richiedendo al contempo adattabilità e cooperazione sia da parte dell’industria che degli organismi di regolamentazione. Le aziende alla ricerca di un fornitore da supportare con le JCA possono trovare in Justin Stindt Consultants un fornitore di servizi di fiducia, che sfrutta l’esperienza della nostra rete di esperti e il track record di successo di dossier P&R nazionali e progetti pan-UE
Tempi e modalità di presentazione della valutazione clinica congiunta (JCA).
La JCA sarà pubblicata entro 30 giorni dalla pubblicazione dell’EPAR. Poiché la pubblicazione della relazione JCA è prevista appena 30 giorni dopo la decisione del CHMP, le procedure nazionali potrebbero iniziare molto rapidamente
Le aziende devono presentare un dossier 45 giorni prima del parere del CHMP. Le specifiche del fascicolo sono determinate nel REGOLAMENTO (UE) 2021/2282: Allegato I per i medicinali e Allegato II per i dispositivi medici e i dispositivi medico-diagnostici in vitro.
L’esito delle JCA viene pubblicato 30 giorni dopo la decisione del CHMP in modo che possa influenzare le procedure nazionali.
Justin Stindt Consultants: un'agenzia di consulenza esperta specializzata in dossier di rimborsabilità e prezzo / JCA

Consultazione scientifica congiunta (JSC): consulenza scientifica paneuropea
Le aziende farmaceutiche, biotecnologiche e medtech potranno inoltre richiedere una consultazione scientifica congiunta (JSC) al gruppo di coordinamento durante la pianificazione degli studi clinici. Per ulteriori informazioni visita la nostra pagina di consultazione scientifica congiunta dell’UE.
Justin Stindt Consultants è la tua agenzia con gli esperti giusti nel supportare la preparazione dei fascicoli JCA. I nostri servizi includono (non limitati a):
- Pianificazione completa del progetto con scadenze e tappe chiare
- Revisione strategica del posizionamento dei farmaci
- Redazione di dossier, sia in inglese che in altre lingue dell’UE
- Convalida del dossier con Key Opinion Leader e payer
- Guida e supporto al processo di sottomissione
- Consulenza strategica e partecipazione alle negoziazioni sul prezzo a livello nazionale
- Gestione efficace del progetto e comunicazione durante tutto il processo
Alla Justin Stindt Consultants, il nostro team di esperti ha una vasta esperienza nel fornire ai clienti un supporto su misura per garantire l’accesso ai pazienti dell’UE il prima possibile, a prezzo e condizioni di rimborso sostenibili.
Lasciate che Justin Stindt Consultants sia la vostra agenzia di fiducia per sbloccare opportunità di prezzo e rimborso (P&R) per il vostro prodotto nell’UE.
Contattateci oggi per scoprire come la nostra azienda può personalizzare i nostri servizi per soddisfare le vostre esigenze specifiche e trasformare in realtà i vostri obiettivi in termini di prezzo e rimborso.
Incontra uno dei nostri esperti UE sui dossier su prezzi e rimborsi

Contattate il nostro esperto
Connettetevi con il nostro team
I nostri esperti specializzati in accesso al mercato sono a portata di clic
TESTIMONIANZE DEI CLIENTI