Bienvenido a Justin Stindt Consultants, su agencia de confianza especializada en Evaluación Clínica Conjunta (JCA) en la Unión Europea (UE). A medida que la Comunidad Europea se embarca en un nuevo proceso paneuropeo de ETS, la JCA tiene como objetivo armonizar la evaluación de terapias innovadoras en todos los estados miembros de la Comunidad Económica Europea. Nuestro equipo global de expertos y consultores domina este panorama transformador y garantiza que sus aplicaciones cumplan con los rigurosos estándares establecidos por el Grupo de Coordinación de Evaluación de Tecnologías Sanitarias (HTACG). Como agencia de consultoría internacional con una trayectoria exitosa en expedientes nacionales de P&R y proyectos pan-UE, enfatizamos la importancia de articular el beneficio adicional de su producto para una entrada exitosa al mercado de la UE. Confíe en Justin Stindt Consultants como su socio para desbloquear el potencial de sus soluciones médicas innovadoras en el marco de acceso al mercado en evolución de la Unión Europea.
Evaluación clínica conjunta (JCA) en la UE: desafíos y oportunidades para las empresas farmacéuticas en el nuevo proceso paneuropeo de HTA
El proceso de Evaluación Clínica Conjunta (JCA) en la Unión Europea representa un nuevo proceso paneuropeo de ETS que se implementará progresivamente a partir de 2025. Si bien muchos esperan que esto signifique un paso significativo hacia la mejora de la evaluación colaborativa de terapias innovadoras entre los estados miembros, todavía existe la preocupación en la industria de que esto conduzca a una duplicación de esfuerzos a nivel nacional y de la UE. JCA busca agilizar y armonizar la evaluación de nuevos tratamientos, con el objetivo de optimizar el acceso de los pacientes a medicamentos y dispositivos médicos de última generación, garantizando al mismo tiempo la rentabilidad y la seguridad del paciente. Justin Stindt Consultants es una agencia especializada en expedientes de ETS nacionales y de la UE (JCA). Nuestro experimentado equipo de consultores y expertos le ayudará a articular el beneficio añadido de su producto en el expediente JCA.
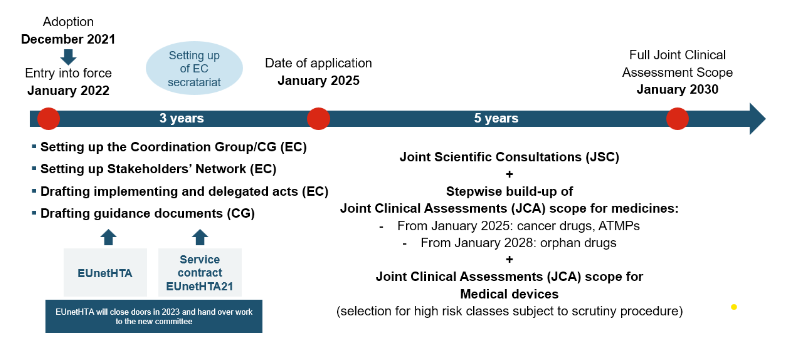
Reglamento HTA: cronograma de implementación y acceso al mercado
La promesa de una evaluación clínica conjunta (JCA) en la UE: un proceso más rápido y eficiente
La JCA será realizada por el Grupo de Coordinación de Evaluación de Tecnologías Sanitarias (HTACG), que fue establecido por el reglamento sobre Evaluación de Tecnologías Sanitarias (HTAR). El subgrupo de Evaluaciones Clínicas Conjuntas asistirá al HTACG. El Grupo de Coordinación reúne a varios organismos nacionales de evaluación de tecnologías sanitarias (ETS) y expertos de diferentes países de la UE para evaluar conjuntamente los datos clínicos y la evidencia que respaldan una terapia en particular. Al aunar recursos y experiencia, JCA tiene como objetivo ofrecer un enfoque eficiente para evaluar el valor clínico y económico de tratamientos innovadores, reduciendo evaluaciones redundantes y acelerando los procesos de toma de decisiones.
Retos de la evaluación clínica conjunta (JCA) en la UE: atender las necesidades de sistemas sanitarios muy diferentes
 Los desafíos en el proceso JCA surgen de la diversidad de los sistemas de salud europeos, las prioridades de tratamiento y las poblaciones de pacientes entre los estados miembros de la UE. Armonizar criterios y alinear métodos de evaluación puede ser complejo y requiere una comunicación y cooperación sólidas entre los países participantes. Además, pueden surgir interpretaciones diferentes de los datos y la evidencia clínica, lo que requiere un diálogo abierto y la creación de consenso durante la evaluación. Un desafío clave es la alineación de los PICO [PICO = Población, Intervención, Comparador(es), y Resultado(s) por sus siglas en inglés], donde los estados miembros pueden tener expectativas muy diferentes dependiendo de su sistema de salud y el conjunto de comparadores disponibles, por ejemplo.
Los desafíos en el proceso JCA surgen de la diversidad de los sistemas de salud europeos, las prioridades de tratamiento y las poblaciones de pacientes entre los estados miembros de la UE. Armonizar criterios y alinear métodos de evaluación puede ser complejo y requiere una comunicación y cooperación sólidas entre los países participantes. Además, pueden surgir interpretaciones diferentes de los datos y la evidencia clínica, lo que requiere un diálogo abierto y la creación de consenso durante la evaluación. Un desafío clave es la alineación de los PICO [PICO = Población, Intervención, Comparador(es), y Resultado(s) por sus siglas en inglés], donde los estados miembros pueden tener expectativas muy diferentes dependiendo de su sistema de salud y el conjunto de comparadores disponibles, por ejemplo.
Para las empresas farmacéuticas y de biotecnología, tanto grandes como pequeñas, el proceso de la JCA en la Unión Europea puede ser a la vez un desafío y un punto de inflexión.
El proceso JCA en la Unión Europea marca un paso significativo hacia la evaluación colaborativa de terapias innovadoras, con el objetivo de simplificar las evaluaciones entre los estados miembros. Esta iniciativa ofrece beneficios potenciales en términos de acceso de pacientes, rentabilidad y eficiencia en la toma de decisiones. Sin embargo, los desafíos surgen de los diversos sistemas de salud y las diferentes interpretaciones de los datos.
Para las empresas farmacéuticas que deseen ingresar al mercado, adaptarse a este enfoque es crucial; Las pequeñas empresas deben participar activamente con los organismos locales de ETS y perfeccionar las metodologías para productos avanzados, mientras que las empresas más grandes deben alinear las estrategias regionales y locales para garantizar la implementación y adopción efectiva de los informes de la JCA. En resumen, la JCA promete mejorar los procesos de evaluación al tiempo que exige adaptabilidad y cooperación tanto de la industria como de los organismos reguladores. Las empresas que buscan un proveedor para apoyar con los JCA pueden encontrar en Justin Stindt Consultants un proveedor de servicios confiable, aprovechando la experiencia de nuestra red de expertos y un historial exitoso de expedientes nacionales de P&R y proyectos pan-UE.
Cronogramas y modalidades de presentación de la evaluación clínica conjunta (JCA)
La JCA se publicará a más tardar 30 días después de la publicación del Informe Público Europeo de Evaluación (European Public Assessment Report – EPAR). Dado que el informe de la JCA se publicará sólo 30 días después de la decisión del Comité de Medicamentos de Uso Humano (Committee for Medicinal Products for Human Use – CHMP), los procedimientos nacionales pueden comenzar muy rápidamente.
Las empresas deberán presentar un dosier 45 días antes de la opinión del CHMP. Las especificaciones del dosier están determinadas en el REGLAMENTO (UE) 2021/2282: Anexo I para medicamentos, y Anexo II para productos sanitarios y productos sanitarios para diagnóstico in vitro.
El resultado de las JCA se publicará 30 días después de la decisión del CHMP para que pueda influir en los procedimientos nacionales.
Justin Stindt Consultants : una agencia de consultoría experta especializada en dosieres de precio y reembolso de la UE / JCA

Consulta Científica Conjunta (Joint Scientific Consultation – JSC): asesoramiento científico paneuropeo
Las empresas farmacéuticas, biotecnológicas y de tecnología médica también podrán solicitar una Consulta Científica Conjunta (JSC) del Grupo de Coordinación cuando se planifiquen los estudios clínicos. Para obtener más información, visite nuestra página de Consulta científica conjunta de la UE.
Justin Stindt Consultants es su agencia con los expertos adecuados para apoyar la preparación de expedientes JCA. Nuestros servicios incluyen (sin limitarse a):
- Planificación integral de proyectos con cronogramas e hitos claros.
- Revisión estratégica del posicionamiento de medicamentos
- Redacción de dosieres, tanto en inglés como en otras lenguas de la UE
- Validación de dosieres con líderes de opinión clave y pagadores
- Orientación y soporte en el proceso de envío
- Asesoramiento estratégico y participación en negociaciones de precios a nivel nacional.
- Gestión eficaz del proyecto y comunicación durante todo el proceso.
En Justin Stindt Consultants, nuestro equipo de expertos tiene una amplia experiencia en brindar a nuestros clientes soporte personalizado para brindar acceso a pacientes de la UE lo antes posible a precios y condiciones de reembolso sostenibles.
Deje que Justin Stindt Consultants sea su agencia socia de confianza para desbloquear oportunidades de precios y reembolsos (P&R) para su producto en la UE.
Contáctenos hoy para saber cómo nuestra firma puede adaptar nuestros servicios para satisfacer sus necesidades únicas y hacer realidad sus objetivos de precios y reembolsos.
Conozca a uno de nuestros expertos de la UE en dosieres de precio y reembolso

Póngase en contacto con nuestro experto
Conecte con nuestro equipo
Nuestros experimentados especialistas en acceso a los mercados están a un solo clic de distancia
TESTIMONIOS DE CLIENTES